国家药品监督管理局10月15日发布《化学药品注射剂仿制药质量和疗效一致性评价技术要求(征求意见稿)》、《已上市化学药品注射剂仿制药质量和疗效一致性评价申报资料要求(征求意见稿)》两项重磅政策,征求意见截止时间是11月15日。前一份政策第三章在生产工艺灭菌/无菌工艺验证方面做出了明确的规定,提出“包装系统密封性验证,方法需经适当的验证”,尤其是无菌灌装产品,明确要求至少开展“直接接触无菌物料和产品的容器密封系统的灭菌验证”等多项验证,并提交验证报告,并且再次强调“包装系统密封性验证,方法需经适当的验证”。
紧随固体制剂一致性评价的铺开,注射剂一致性评价至此已经开弓射箭。无菌药品生产中有许多因素可导致药品包装容器密封性缺失,影响药品质量,GMP实施指南中明确规定无菌药品包装容器的密封性应经过验证,以避免产品遭受污染。微生物挑战法、色水法、饱和盐水法等传统验证方法,由于检测效率低、精度不高、验证过程甚至可能直接污染药品等诸多原因,大规模应用受到制约。楚天科技无损、高精度的高压放电法、激光顶空分析法,可良好应用于无菌药品包装容器密封性验证,帮助制药企业规避传统方法的弊端和风险,应对注射剂一致性评价。
国家药品监督管理局
《化学药品注射剂仿制药质量和疗效一致性评价技术要求》
(征求意见稿)
★ 灭菌/无菌工艺验证
对于终端灭菌药品,至少进行并提交以下验证报告:
? 药品终端灭菌工艺验证;
? 直接接触药品的内包材的除热原验证或供应商出具的相关证明资料;
? 包装系统密封性验证,方法需经适当的验证;
? 保持时间(含化学和微生物)验证。
★ 对于无菌灌装产品,至少进行并提交以下验证报告:
? 除菌工艺的细菌截留验证;
? 如不采用过滤除菌而采用其他方法灭菌,提供料液/大包装药的灭菌验证;
? 直接接触无菌物料和产品的容器密封系统的灭菌验证;
? 直接接触产品内包材的除热原验证或供应商出具的相关证明资料;
? 无菌工艺模拟试验验证,并明确试验失败后需要采取的措施;
? 包装系统密封性验证,方法需经适当的验证;
? 保持时间(含化学和微生物)验证。
高压放电法
就基本原理而言,高压放电检漏法是一种基于有无漏孔下容抗特性差异的一种密封完整性检测方法,在容器上加载高压电,有漏孔时电流会显著增大,此时可以通过设置阈值来判断容器密封性。
这一方法无损可靠,获得美国药典USP1207和FDA的认可。这项检测方法,要求容器中的药液电导率达到5μS/cm,并且药品为非易燃易爆液体,适用于安瓿水针、西林瓶水针、口服液、三合一及软袋等产品的密封完整性检查。
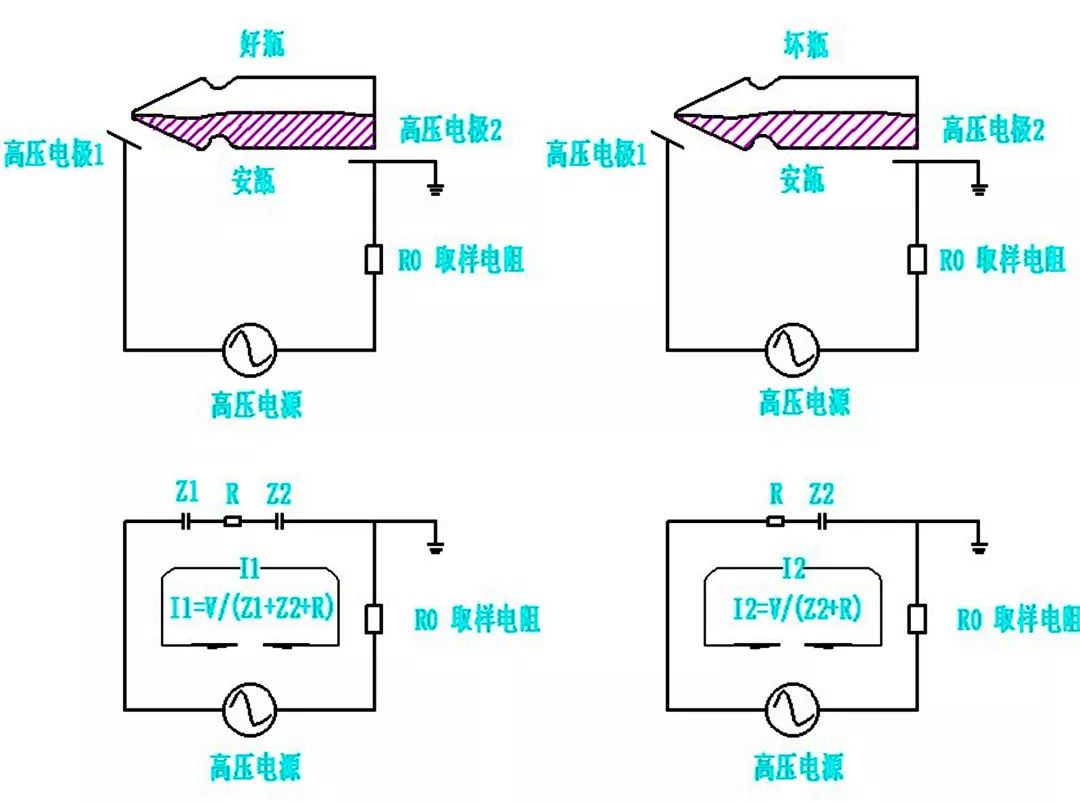
安瓿高压放电检漏原理示意图
验证方法
替代法
将管或移液管插入包装从而制成阳性对照,这一方法成本相对较低并且操作简单,但在许多情况下,管或移液管与包装周围所客观存在的缝隙,无法将其完全密封,就会形成假阳性对照。同时在人工操作过程中,存在操作不当引起堵塞缺陷的风险。
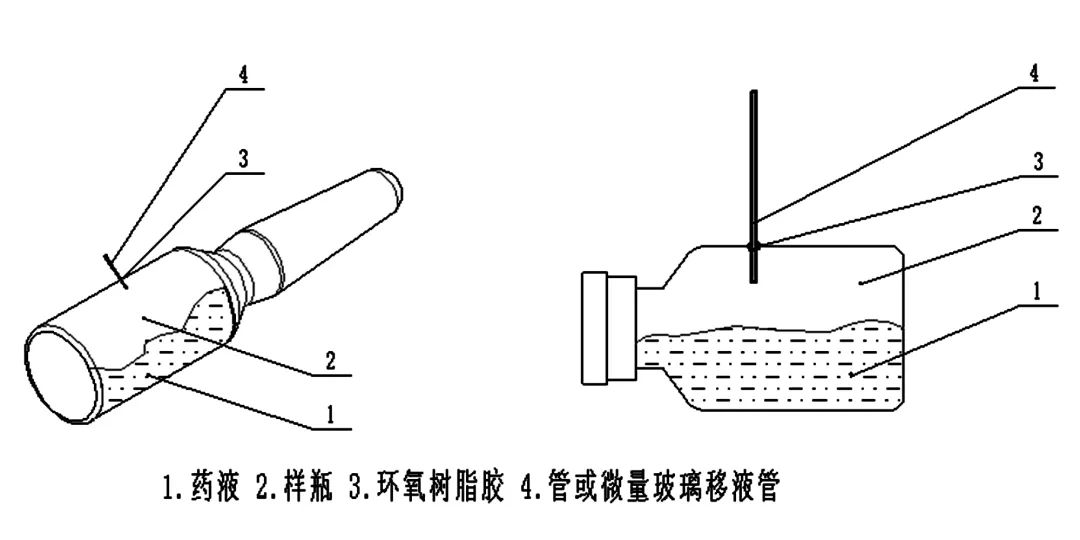
替代法示意图
对比法
与色水法、微生物挑战法对比验证,这一方法适用于批量对比验证,成本相对较低。其中,色水法对比验证相比微生物挑战法对比验证周期短。此外,对比验证方法主要验证高压放电法是否优于色水法,无法验证高压放电法的检测精度。
微孔验证法
激光在包装上钻孔并验证微孔当径大小,从而形成阳性对照。在验证时,可直接对阳性对照样品与阴性对照样品进行高压放电法测试。这一方法能够验证密封容器完整性方法,具备查找可能出现缺陷的能力,具备较准确地验证密封容器完整性方法的检测最小微孔的能力。它的弱点在于:成本高,并且验证精度受制于激光钻孔与检测手段的最大能力。

激光钻孔的图片
高压放电法验证包装容器密封完整性
密封性检测技术不断发展,高压放电检漏随之越来越多地应用于生产。相比色水法、微生物挑战法等传统方法,它具备以下优势:
零污染。检测电极与药品无直接接触,不使用染色液等液体,对药品不会产生任何污染。
高准确度。可检测出传统方法无法检出的超细微裂纹和微孔,检漏精度高,理论可达0.2μm,并可进行重复检测。
高安全性。加载在产品上的能量低、时间短,不会破坏产品内药液化学成分,已应用于疫苗、血液等高敏感生物制剂,比如高蛋白制品、含有活病毒的产品、含有活细胞的产品。此外,由于是微量电流,即使误触碰到电极也不会发生生命危险。
零破坏。实现容器的非破坏检测,根据容器不同的耐电压值,设定不同的加载电压,保护容器的自身材质。
高效率:既可单机生产,也可与生产线联动,实现了全自动100%在线对被检容器单个检测。

楚天科技AILM80型灯检检漏一体机
楚天科技基于高压放电的自动检漏机,可与基于机器视觉检测的灯检机连线,适用于安瓿瓶、西林瓶、口服液瓶的检测,全伺服控制系统,最高检测速度可达600瓶/分钟,异物检测精度达40μm,检漏精度优于0.2μm。
激光检测法
就基本原理而言,激光检测法是运用TDLAS(可调谐半导体激光吸收光谱)激光检测技术,检测无菌制剂容器密封完整性的一种无损、定量方法,该方法通过测量瓶内氧气浓度信息来判断容器密封性是否缺失,尤其适用于抽真空、或者充氮气的冻干药品容器,美国药典USP 1207.2明确激光顶空分析法能够进行顶空真空度分析。
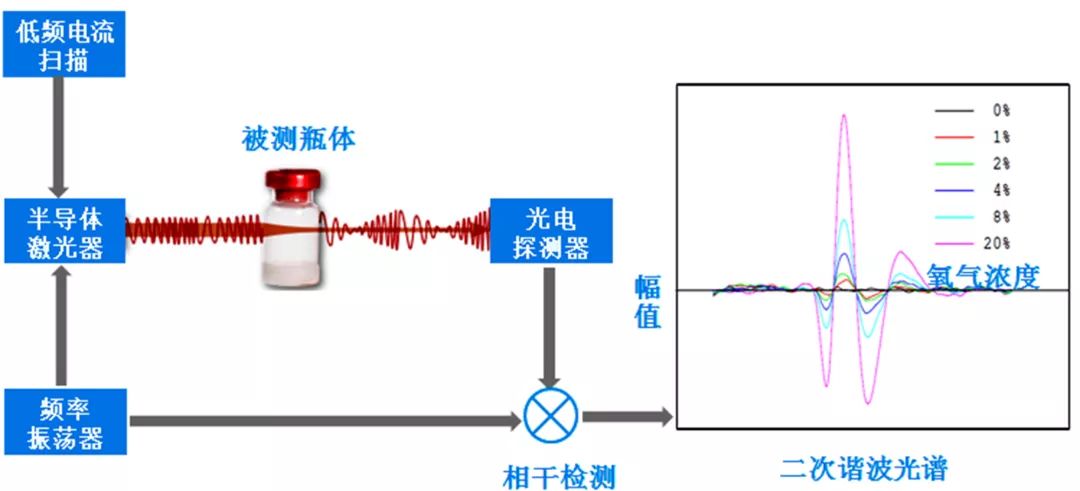
TDLAS激光检测技术原理图
在冻干粉剂工艺中,无菌容器加塞前经过了抽真空或者抽真空后充氮的工艺,瓶体内部的氧气浓度接近为0,容器和胶塞系统由于自身瑕疵或者封装、轧盖工艺问题,都可能使容器内部与外界连通,从而使容器内外发生气体交换。
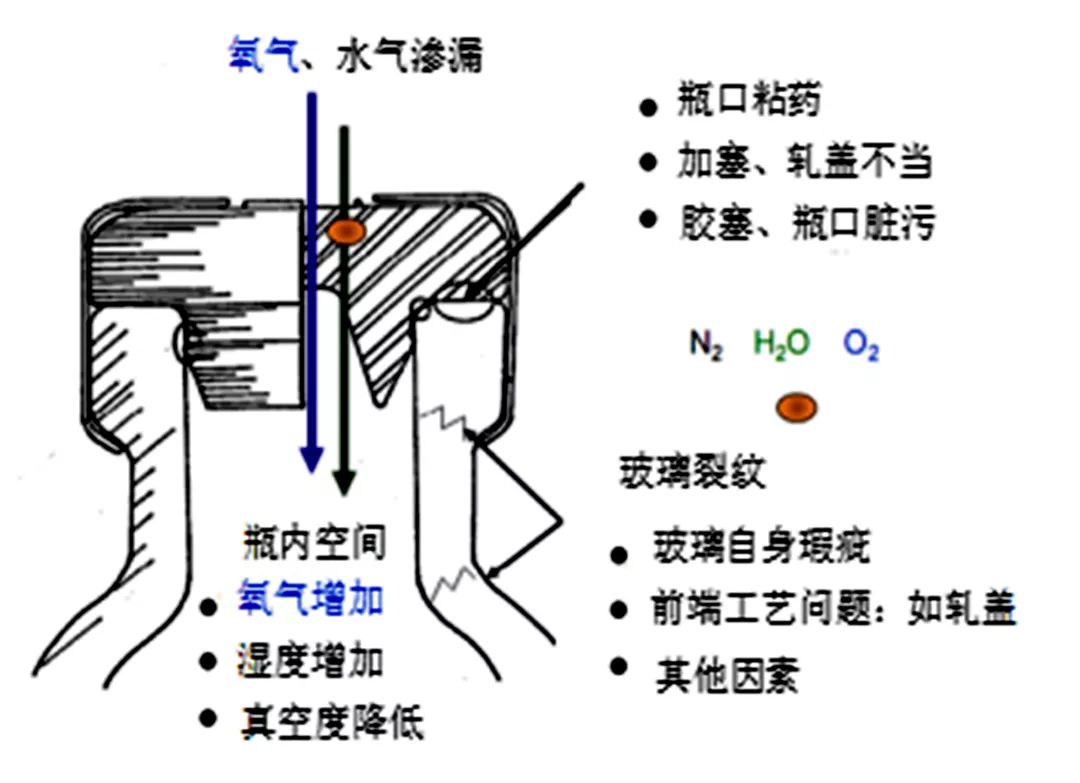
多种因素致使瓶体内氧气浓度发生变化
容器的泄露速率
容器泄露速率与容器尺寸、漏孔大小以及初始顶空压力相关。当容器初始为真空时,一旦存在漏孔,由于外界大气压的作用,空气将快速逸散进入瓶体内部使内部氧气浓度增加。当容器内初始存在1atm氮气时,外界气体分子只能通过扩散作用,与瓶体内部氮气发生交换,最终达到动态平衡,瓶内外氧气浓度均为20.9%。
PDA(美国药物协会)文件的一张图片,显示了1ml安瓿瓶初始1atm氮气下不同漏孔氧气浓度的变化,可以看出4.38μm、10.75μm和14.04μm的漏孔,经过约1天(1440分钟)后瓶体内部氧气浓度达到约20.9%,瓶内外气体达到动态平衡,此时瓶体完全泄露。
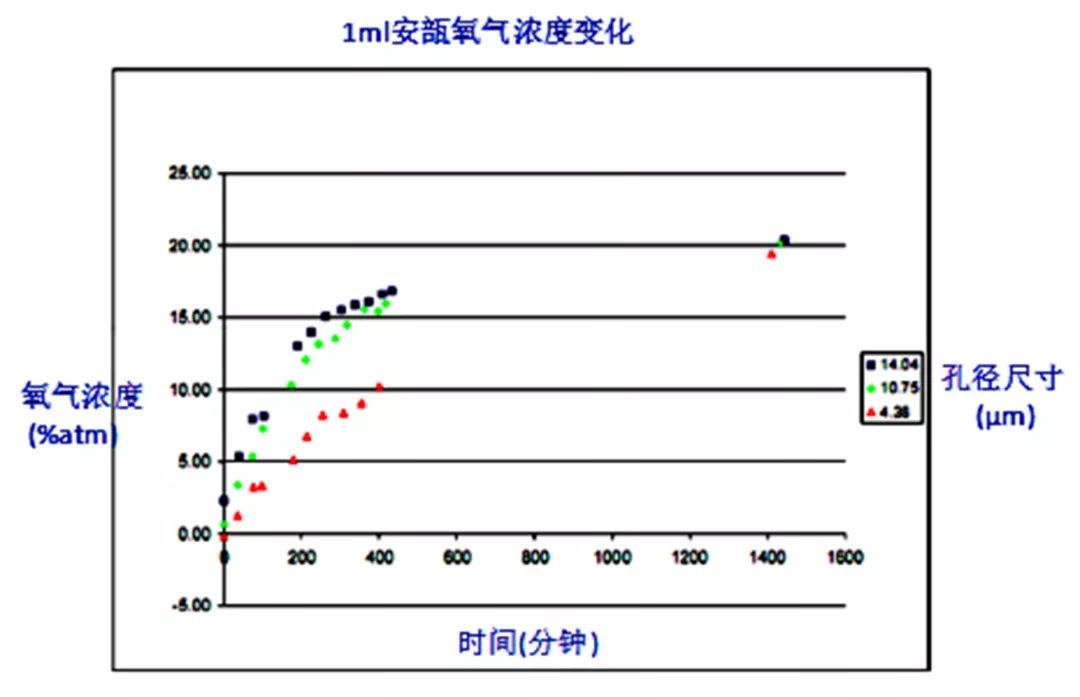
1atm氮气下1ml安瓿不同漏孔泄露速率
激光顶空分析法验证包装容器密封完整性
目前,国内制药企业大多采用破坏性方法来测量真空度或氧气浓度,来实现对冻干药品密封完整性的验证。而显然,破坏性检测只适用于少量药品抽检。因为,当药品生产达到一定量时,总会有漏气药品产生;甚至在应用中发现胶塞与瓶体匹配不严时,瓶体出冻干机至铝塑盖轧盖前,造成大量药品漏气,采用抽检方法显然不能解决这类问题。因此,我们可以采用激光顶空分析实验室检测仪和在线检测设备来监控冻干药品的密封完整性。
实验室检测仪方面,根据泄露检测模型,我们可以通过激光法轻易地判断瓶体的泄露情况,而且如若测得瓶体内部含有一定量的氧气浓度,可以放置一段时间进行再次测量,比如0、3、6、9个月分别测量,真正实现货架期药品的监控。更进一步,我们可以使用在线顶空分析方法来检测每支药瓶的密封性,楚天科技的在线激光顶空分析设备最快速度可达600瓶/分钟,根据不同的瓶体直径最低浓度限可检至2%,且可与视觉检测相融合。

激光检测与视觉检测相融合
文 / 楚天科技中央技术研究院智能检测与视觉识别技术产品线 李伟、朱剑平
推荐阅读
最新 | 注射剂一致性评价重磅文件两连发
每小时分装3万瓶!Romaco新型无菌粉末分装设备即将亮相2019秋季全国药机展

楚
天

楚天科技 官方微信
ID:楚天人
