生物化学专题研究读书报告(二)| NPHP1蛋白质N端折叠片段可抑制细胞凋亡
引言
生物化学是研究生命的分子和化学反应的科学,是运用化学的原理和语言在分子水平上解释生命现象的一门学科。生物化学是介于生物学和化学之间的重要交叉学科,是药学专业学生非常重要的基础课程。因此,教学团队在课程教学过程中开展“生物化学专题研究”活动,通过学生阅读生物化学相关最新文献,撰写专题推送文章,加强他们对基础知识的理解与运用,增进师生间的交流互动。本微信公众平台每周将推送经师生投票选出的最优作品,供更多读者阅读和了解。
研究背景
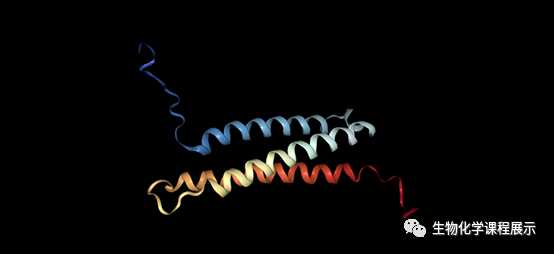
Valeria Mannella研究团队近日发现,蛋白质NPHP1能在溶液中折叠成单体三链反平行卷曲的线圈结构,且该区域对细胞凋亡有一定的抑制作用。
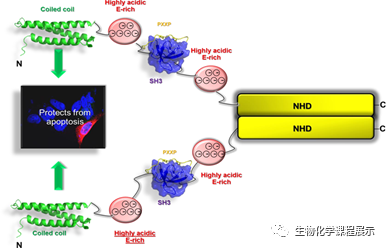
图1. Nephrocystin-1 工作模式
NPHP1(Nephrocystin-1)是由突变所诱发常染色体隐性遗传疾病肾单位肾痨(NPH)中的主要基因——其指导合成的蛋白质,在肾上皮细胞的形成与蛋白质转运中起重要作用。
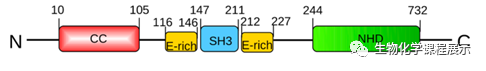
图2. 人类NPHP1的结构域
NPHP1中包含一个SH3域,两侧有两个富E结构域。NPHP1和其他NPHP蛋白家族成员一样,它的N端(包含前115个氨基酸)带有推定的螺旋线圈结构域NPHP1CC,虽然之前的结构研究推断该片段对它本身低聚合和蛋白质相互作用有着重要意义,然而其折叠形态和低聚能力尚未被证实。
研究内容
为进一步了解NPHP1 N端折叠区域的分子结构与生物功能,研究人员对推测的卷曲螺旋区域(NPHP1CC)中的115个残基构建体进行结构化(圆二色谱,NMR光谱,分析超速离心)和功能化(TUNEL法)的分析,得到了意想不到的结果:NPHP1CC在溶液中形成卷曲的单体三链反平行线圈结构。
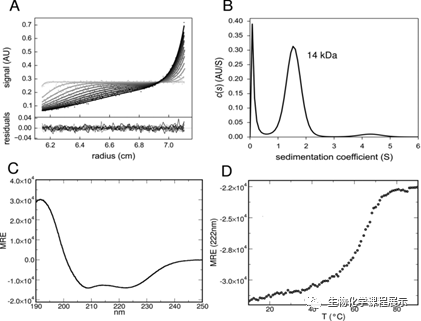
图3. (A)NPHP1CC在1 mg mL-1下的沉降速度曲线(B)沉积系数(S)分布(C)NPHP1CC的远紫外圆二色光谱(CD)显示了典型的α螺旋曲线(D)远紫外CD光谱法在222nm处监测的NPHP1CC热变性曲线
沉降系数的测定和远紫外光谱法分析均证实,在溶液中,NPHP1CC在很宽的浓度范围内(从μM级到mM级)都能折叠成高α-螺旋含量的稳定单体结构(图3),因此不具有在体外聚合的功能。
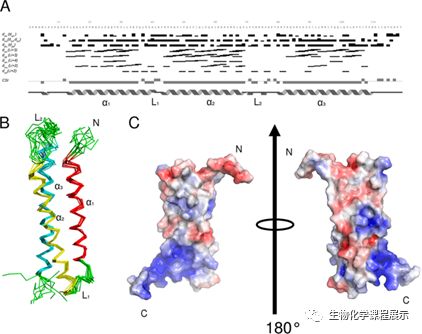
图4. NPHP1CC的溶液中的结构. (A)CSI预测的实验中NOE和二级结构元素分析; (B)NMR溶液结构,含三个螺旋α1(红色),α2(黄色)和α3(青色);环L1和L2为绿色; (C)表面电荷分布(正电荷(蓝色)和负电荷(红色))
接下来的NMR实验,Overhauser效应(NOE)分析表明,该结构域具有全α螺旋折叠,NPHP1CC由三个相互作用的右手反平行α螺旋所组成,螺旋α1和α2由L1环连接,α2和α3则通过L2环连接。N和C末端则保持无序。总体而言,带电荷的氨基酸均匀地分布在结构域的表面上,表面静电势无明显的极化分布。
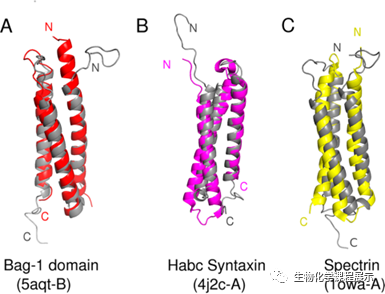
图5.NPHP1CC的结构类似物。NPHP1CC(灰色阴影)排列与三个代表(Z score > 9)的Dali hits。(A)BAG1(红色);(B)Habc Syntaxin(洋红色);(C)血影蛋白(黄色)
为探究NPHP1CC的生物学作用,研究人员搜索了含有与NPHP1CC结构相似的蛋白或蛋白结构域,在高度匹配结果中Z得分最高的是Bcl-2关联的BAG域,其常在参与细胞凋亡的蛋白质中被发现。此外,NPHP1CC中一个螺旋间的疏水性沟槽与突触前膜蛋白中的Habc域(与蛋白质运输密切相关)的某些结构相似;另外,血影蛋白和肌养蛋白中负责募集结构蛋白和信号蛋白的血影蛋白重复序列(spectrin repeat)的平台三螺旋也与NPHP1CC有一定的相似性。
为了证实NPHP1CC片段对肾上皮细胞凋亡的抑制作用,研究人员使用了带有myc标记的全长NPHP1基因(myc-NPHP1FL),同时缺少NPHP1CC卷曲螺旋结构域的缺失突变体(mycNPHP1ΔCC)细胞,测量了对TNFα刺激诱导的凋亡反应的细胞活力:
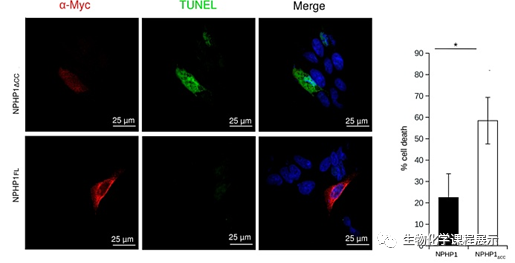
图6.左:NPHP1△cc和NPHP1FL的染色情况(红色荧光用于确认已转染成功) 右表:TNFα诱导的凋亡转染细胞的百分比
此外,又使用了针对Caspase-3裂解形式的抗Capase-3抗体进行了相似的分析:
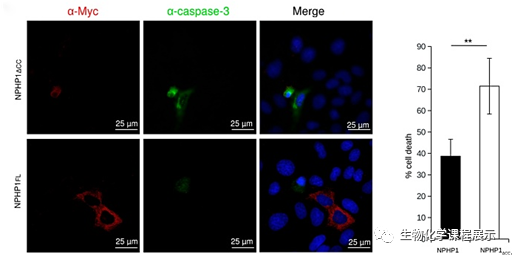
图7. 左:NPHP1△cc和NPHP1FL的染色情况 右表:在转染的细胞中切割的caspase-3的百分比
定量分析(图6,右;图7,右)证实与野生型蛋白转染的细胞相比,卷曲螺旋结构域的缺失导致细胞凋亡增加。
总结与展望
这篇研究首次对NPHP1的N端结构域的结构与功能做出了准确评估。NPHP1CC在溶液中形成卷曲的单体三链反平行线圈结构,并推测其对信号转导、蛋白质运输、影响细胞凋亡等生命活动有所影响。又通过体外细胞实验证实了NPHP1CC直接参与细胞凋亡的抑制活动。未来的工作可集中于NPHP1CC或其他蛋白质结构域的NPHP1突变是否影响其折叠或功能。
参考文献
[1] Mannella, V., et al., The N-Terminal Domain of NPHP1 Folds into aMonomeric Left-Handed Antiparallel Three-Stranded Coiled Coil withAnti-apoptotic Function. ACS Chem Biol, 2019. 14(8): p. 1845-1854.
[2] Wodarczyk,C., et al., Nephrocystin-1 forms acomplex with polycystin-1 via a polyproline motif/SH3 domain interaction andregulates the apoptotic response in mammals. PLoS One, 2010. 5(9): p. e12719.
[3] 封面图来源:PDB数据库
作者信息
中山大学药学院
作者:陈思睿17325014、成悦17325020
指导老师:黄志纾、欧田苗、陈硕斌
编辑:蒋昕晨