
中考化学金属和金属材料考点梳理
考点一、金属材料
(一)、纯金属材料:纯金属(90多种)


(二)、合金(几千种):由一种金属跟其他一种或几种金属(或金属与非金属)一起熔合而成的具有金属特性的物质。
1. 金属材料包括纯金属和合金两类。金属属于金属材料,但金属材料不一定是纯金属,也可能是合金。
2. 合金可能是金属与金属组成,也可能是金属与非金属组成。金属材料中使用比较广泛的是合金。
合金的优点:(1)熔点高、密度小;(2)可塑性好、易于加工、机械性能好;(3)抗腐蚀性能好;
合金
铁的合金
铜合金
焊锡
钛和钛合金
形状记忆金属
生铁
钢
黄铜
青铜:
成分
含碳量
2%~4.3%
含碳量
0.03%~2%
铜锌
合金
铜锡
合金
铅锡
合金
钛镍合金
备注
不锈钢:含铬、镍的钢
具有抗腐蚀性能
紫铜为纯铜
熔点低
下面是黄铜和铜片,焊锡和锡,铝合金和铝线的有关性质比较:
性质比较
铜
锡
铝
黄铜
铜
焊锡
锡
铝合金
铝
光泽与颜色
黄色
有光泽
紫红色
有光泽
深灰色
金属光泽
银白色
有光泽
银白色
有光泽
银白色
有光泽
硬度
比铜大
坚韧
硬度大
质软
坚硬
质软
熔点
比铜低
较高
比锡低
较低
比铝低
较高
钛和钛合金:被认为是21世纪的重要金属材料,钛合金与人体有很好的“相容性”,因此可用来制造人造骨等。钛合金的优点:① 熔点高、密度小;② 可塑性好、易于加工、机械性能好;③ 抗腐蚀性能好
钛镍合金具有“记忆”能力,可记住某个特定温度下的形状,只要复回这个温度,就会恢复到这个温度下的形状,又被称为“记忆金属”。此外,钛还可制取超导材料,美国生产的超导材料中的90%是用钛铌合金制造的。
3. 注意:
(1)合金是金属与金属或金属与非金属的混合物。
(2)合金的很多性能与组成它们的纯金属不同,使合金更容易适于不同的用途。
(3)日常使用的金属材料,大多数为合金。
(4)金属在熔合了其它金属和非金属后,不仅组成上发生了变化,其内部组成结构也发生了改变,从而引起性质的变化。
4. 2.合金的形成条件:其中任一金属的熔点不能高于另一金属的沸点(当两种金属形成合金时)。
5. 青铜是人类历史上使用最早的合金;生铁和钢是人类利用最广泛的合金.
6. 合金都属于混合物。
考点2金属的物理性质
(1)常温下一般为固态(汞为液态),有金属光泽。
(2)大多数呈银白色(铜为紫红色,金为黄色)
(3)有良好的导热性、导电性、延展性
(4)密度和硬度较大,熔沸点较高。
注:金属的物理性质是只所有金属都有的共同性质,而不是指某一金属的特有性质。
考点3 金属之最
(1)铝:地壳中含量最多的金属元素
(2)钙:人体中含量最多的金属元素
(3)铁:目前世界年产量最多的金属(铁>铝>铜)
(4)银:导电、导热性最好的金属(银>铜>金>铝)
(5)铬:硬度最高的金属
(6)钨:熔点最高的金属
(7)汞:熔点最低的金属
(8)锇:密度最大的金属
(9)锂 :密度最小的金属
考点4金属与氧气的反应
金属
条件
反应方程式
现象
Mg
常温下(在空气中
2Mg+O2 =2MgO
银白色镁条在空气中表面逐渐变暗,生成白色固体。
点燃时(在空气中或在氧气中)
点燃
2Mg+O2 ======2MgO
剧烈燃烧,发出耀眼的白光,生成一种白色固体。
Al
常温下(在空气中)
4Al+3O2 =2Al2O3
银白色的表面逐渐变暗,生成一层致密的薄膜。
点燃时(在氧气中)
点燃
4Al+3O2 ====2Al2O3
剧烈燃烧,放出大量的热和耀眼的白光,生成白色固体。
Fe
常温下,干燥的空气
常温下,在潮湿的空气中
铁与空气中的氧气和水共同作用下会生成暗红色疏松的物质——铁锈(Fe2O3·H2O)
在氧气中点燃
点燃
3Fe+2O2 ======Fe3O4
剧烈燃烧,火星四射,放出大量的热,生成一种黑色固体。
Cu
常温下,干燥的空气
加热时
△
2Cu+O2 =====2CuO
铜丝表面逐渐变为黑色
在潮湿的空气中
2Cu+O2+CO2+H2O=Cu2(OH)2CO3
铜表面生成一层绿色物质
Au、Ag
即使在高温下也不与氧气反应“真金不怕火炼”。
结论:大多数金属都能与氧气反应,但反应的难易和剧烈程度不同。Mg、Al等在常温下就能与氧气反应;Fe、Cu等在常温下几乎不能单独与氧气反应,但在点燃或加热的情况下可以发生反应;Au、Ag等在高温时也不与氧气反应。
考点5金属与酸的反应
金属
现象
反应的化学方程式
稀盐酸
稀硫酸
稀盐酸
稀硫酸
镁
剧烈反应,产生大量气泡,溶液仍为无色,试管壁发热,生成的气体能够燃烧并且产生淡蓝色火焰。
Mg+2HCl =MgCl2+H2

Mg+H2SO4=MgSO4+H2

锌
反应比较剧烈,产生大量气泡,溶液仍为无色,试管壁发热,生成的气体能够燃烧并且产生淡蓝色火焰。
Zn+2HCl =ZnCl2+H2

Zn+H2SO4=ZnSO4+H2

铁
反应缓慢,有气泡产生,溶液由无色逐渐变为浅绿色,生成气体能够燃烧并且产生淡蓝色火焰。
Fe+2HCl =FeCl2+H2

Fe+H2SO4 =FeSO4+H2

铜
不反应
结论:Mg、Zn、Fe的金属活动性比铜强,它们能置换出稀硫酸或稀盐酸中的氢。
考点6属与化合物溶液的反应
实验操作
现象
反应的化学方程式
质量变化
应用
铁丝浸入硫酸铜溶液中
浸入溶液的铁钉表面覆盖一层紫红色的物质,溶液由蓝色逐渐变为浅绿色
Fe+CuSO4= Cu+FeSO4
金属质量增加,溶液质量减少
不能用铁制品放硫酸铜溶液(或农药波尔多液)
铝丝浸入硫酸铜溶液中
浸入溶液的铝丝表面覆盖一层紫红色的物质,溶液由蓝色逐渐变为无色
2Al+3CuSO4=Al2(SO4)3+3Cu
金属质量增加,溶液质量减少
铜丝浸入硝酸银溶液中
浸入溶液的铜丝表面覆盖一层银白色的物质,溶液由无色逐渐变为蓝色
Cu+2AgNO3=Cu(NO3)2+2Ag
金属质量增加,溶液质量减少
铜丝浸入硫酸铝溶液中
结论:1.以上四种金属的活动性由强到弱的顺序为:Al>Fe>Cu>Ag
2.活泼性强的金属能把活泼性弱的金属从其化合物溶液中置换出来。
注意:1.此类反应一定在溶液中进行,不溶于水的化合物一般不与金属反应。
2. K、Ca、Na活动性非常强,但不能用它们置换化合物中的金属,因为它们能同溶液中的水剧烈反应。
考点 7 置换反应
置换反应:由一种单质与一种化合物反应,生成另一种单质与化合物的反应叫做置换反应。
考点8 金属活动性顺序
1、常见金属的活动性顺序:
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
2、意义:①H代表酸中的氢元素;②金属的位置越靠前,它的活动

性就越强;③在金属活动性顺序里,位于氢前面的金属能置换出盐酸、稀硫酸中的氢(不可用浓硫酸、硝酸);④位于前面的金属能把位于后面的金属从它们的盐溶液中置换出来。(除K、Ca、Na)
3、应用:①用于判断金属是否与酸发生置换反应;②用于判断金属与酸发生化学反应的剧烈程度;③用于判断金属与盐能否发生置换反应。
注意:▲▲▲
1、金属与盐的反应必须在“盐溶液”中进行,否则不能反应,如:Cu可以与AgNO3溶液反应置换出Ag,但不能与AgCl反应。
2、也可根据反应是否发生及反应剧烈程度来判断金属的活动性强弱。
3、K、Ca、Na三种金属的活动性太强,除与酸反应外,还能与水在常温下发生置换反应(如2Na+2H2O=2NaOH+H2↑),其余金属则不能
考点9矿石
1. 金属资源的存在方式:地球上的金属资源广泛存在于地壳和海洋中,大多数金属化合物性质较活泼,所以它们以化合物的形式存在;只有少数金属化学性质很不活泼,如金、银等以单质形式存在。
2. 矿石:工业上把能提炼金属的矿物叫矿石。
3. 常见矿石名称与其主要成分:
名称
赤铁矿
黄铁矿
菱铁矿
磁铁矿
铝土矿
黄铜矿
辉铜矿
主要成分
Fe2O3
FeS2
FeCO3
Fe3O4
Al2O3
CuFeS2
Cu2S
考点10一氧化碳还原氧化铁
1、炼铁的基本原理是:在高温条件下,利用焦炭与氧气反应生成的一氧化碳把铁从铁矿石里还原出来。3CO + Fe2O3高温2Fe + 3CO2
2、炼铁的原料:铁矿石[常见的铁矿石有磁铁矿(主要成分是Fe3O4)和赤铁矿(主要成分是Fe2O3)]、焦炭、石灰石和空气,主要设备是高炉。
(1)仪器:铁架台(2个)、硬质玻璃管、单孔橡皮赛(2个)、酒精灯、试管、酒精喷灯、双孔橡皮赛、导气管。
(2)药品:氧化铁粉末、澄清石灰水、一氧化碳气体
(3)装置图:
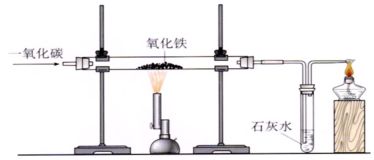
(4)步骤:①检验装置的气密性;②装入药品并固定;③向玻璃管内通入一氧化碳气体;④给氧化铁加热;
⑤停止加热;⑥停止通入一氧化碳。
(5)现象:红色粉末逐渐变成黑色,澄清石灰水变浑浊,尾气燃烧产生蓝色火焰。
(6)化学方程式:
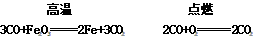
Ca(OH)2+CO2=CaCO3↓+H2O
(7)注意事项:与CO还原氧化铜的实验操作顺序一样,即先通入CO再加热,实验完毕,停止加热,继续通入CO至试管冷却。
②、实验主要现象:红色粉末变为黑色时,澄清的石灰水变

浑浊,尾气点燃产生淡蓝色火焰。
③实验注意事项:先能后点,先撤后停

。
(8)尾气处理:因CO有毒,不能随意排放在空气中,处理的原则是将CO燃烧掉转化为无毒的CO2或收集备用。
考点11工业炼铁
(1)原理:在高温下,利用焦炭与氧气反应生成的还原剂(CO)将铁从铁矿石里还原出来。
(2)原料:铁矿石、焦炭、石灰石和空气
(3)主要设备:高炉
(4)冶炼过程中发生的化学反应:
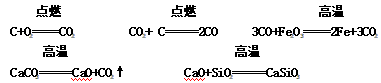
注意:石灰石的主要作用是将矿石中的二氧化硅转变为炉渣。
铁的锈蚀
(1)铁生锈的条件是:铁与O2、水接触(铁锈的主要成分:Fe2O3·xH2O)
(2)防止铁制品生锈的措施:
①保持铁制品表面的清洁、干燥
②表面涂保护膜:如涂油、刷漆、电镀、烤蓝等
③制成不锈钢
(3)铁锈很疏松,不能阻碍里层的铁继续与氧气、水蒸气反应,因此铁制品可以全部被锈蚀。因而铁锈应及时除去。
(4)铝与氧气反应生成致密的氧化铝薄膜,从而阻止铝进一步氧化,因此,铝具有很好的抗腐蚀性能。
注意:
1、铜生铜绿的条件:铜与O2、水、CO2接触。铜绿的化学式:Cu2(OH)2CO3)。
(1)铁生锈的条件是:铁与O2、水接触。
铁锈的主要成分是氧化铁Fe2O3(红棕色)
(铜生铜绿的条件:铜与O2、水、CO2接触。铜绿的化学式:Cu2(OH)2CO3)
(2)防止铁制品生锈的措施:
①保持铁制品表面的清洁、干燥
②表面涂保护膜:如涂油、刷漆、电镀等
③制成不锈钢
考点16 金属资源的保护和利用
1、金属资源的保护:
①防止金属腐蚀;
②回收利用废旧金属;
③合理开采矿物;
④寻找金属的代用。
2、金属回收再利用的意义:
①防止污染环境;②节约能源;③节约资源。
声明:文章来源于网络,版权归原作者所有,如有侵权联系小编立即删除!
请关注我们的公众微信号,并告诉您身边的朋友,让我们一路伴随孩子快乐成长。有你,有伟林,生活更精彩!!!
(微信号:Hepuweilin)
