↑↑↑点击上方蓝字关注我们,获取更多高中学科资料!

【广州高中微课】持续更新高中各科章节知识点讲解、重难点分析、提分技巧,以及月考、期中、期末考试复习资料等。
欢迎关注我们,及时获取最新学习资料!

高一化学期中复习
模块一

一、物质的量 摩尔质量
1.物质的量及其单位
(1)定义:表示含有一定数目微观粒子的集合体的物理量。符号为n。
(2)单位:摩尔,简称摩,符号为mol。
2.阿伏加德罗常数
(1)定义:12g 12C所含的碳原子数为阿伏加德罗常数,其数值约为6.02×1023,单位mol-1,符号NA。
(2)计算公式:物质的量n、阿伏加德罗常数NA与粒子数N之间的关系为NA=nN。
3.摩尔质量
(1)定义:单位物质的量的物质所具有的质量。符号为M。单位:g/mol(或g·mol-1)。
(2)数值:当摩尔质量以 g·mol-1为单位时,在数值上等于该物质的相对分子质量(或相对原子质量)。
(3)计算公式:物质的量n、物质的质量m、摩尔质量M之间的关系为M=nm。
【易错警示】
(1)物质的量描述的对象是微观粒子,不能用于描述宏观物体。
(2)阿伏加德罗常数有单位,6.02×1023只是阿伏加德罗常数的一个近似值。
(3)摩尔质量的单位为g·mol-1,相对原子(分子)质量的单位为1,1 mol物质的质量单位为g。
(4)对具体的物质,其摩尔质量是确定的。
(5)转化为n再进行计算。
二、气体摩尔体积 阿伏伽德罗定律
1. 影响物质体积的因素:粒子数目,粒子的大小,粒子的间距。
影响气体体积的因素:粒子数目,粒子的间距。
影响液体固体体积的因素:粒子数目,粒子的大小。
2. 气体摩尔体积
(1)定义:一定温度和压强下,单位物质的量的气体所占的体积。符号为Vm。单位为L/mol(或L·mol-1)。
(2)标准状况下的气体摩尔体积:在标准状况下(指温度为0_℃,压强为101_kPa)约为22.4_L·mol-1。
(3)计算公式:物质的量n、气体体积V、气体摩尔体积Vm之间的关系:Vm=nV。
(4)影响因素:气体摩尔体积的数值不是固定不变的,它决定于气体所处的温度和压强。
【易错警示】
(1)使用22.4mol/L的条件:气体,标况。
(2)标况下不是气体的物质:水,CCl4,苯,SO3
(3)标况Vm=22.4 mol/L 但Vm=22.4mol/L 不一定是标况
3. 阿伏伽德罗定律
(1)公式:pv=nRT在相同的温度和压强下 相同体积的任何气体含有相同数目的分子(或气体的物质的量相同)。
(2)适用范围:单一气体或相互不反应的混合气体。
(3)有关密度的推论:ρ=M/Vm 同温同压下,ρ与M成正比
【易错警示】
求M的两种常用方法:
(1)根据标准状况下气体的密度ρ:M=ρ×22.4(g·mol-1)。
(2)根据气体的相对密度
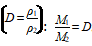
。
Eg:同温同压下,某种气体相对于H2的密度为12,D(相对密度)=12,则该气体的摩尔质量为:24g/mol
以上仅为部分内容
完整文档请于文末获取!
高一化学期中复习
模块二

一、物质的量浓度
(1)物质的量浓度定义:用单位体积的溶液里含有溶质B的物质的量来表示溶液组成的物理量,叫作溶质B的物质的量浓度。
(2)计算公式:
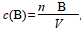
,符号:c(B),单位:mol/L(或mol·L-1)。
【易错警示】
(1)正确判断溶液的溶质并计算其物质的量
① 与水发生反应生成新的物质,如Na、Na2O、Na2O2―→NaOH,SO3―→H2SO4
② 含结晶水的物质:CuSO4·5H2O―→CuSO4,Na2CO3·10H2O―→Na2CO3。
③ 特殊物质:如NH3溶于水后溶质为NH3·H2O,但计算浓度时是以NH3分子作为溶质。
(2)准确计算溶液的体积
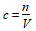
中的V是溶液的体积,不是溶剂的体积,也不是溶质和溶剂的体积之和,不能用水的体积代替溶液的体积,应根据
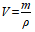
计算。
(3)气体溶于水的计算
气体溶于水,求溶液中溶质的物质的量浓度的一般思路:
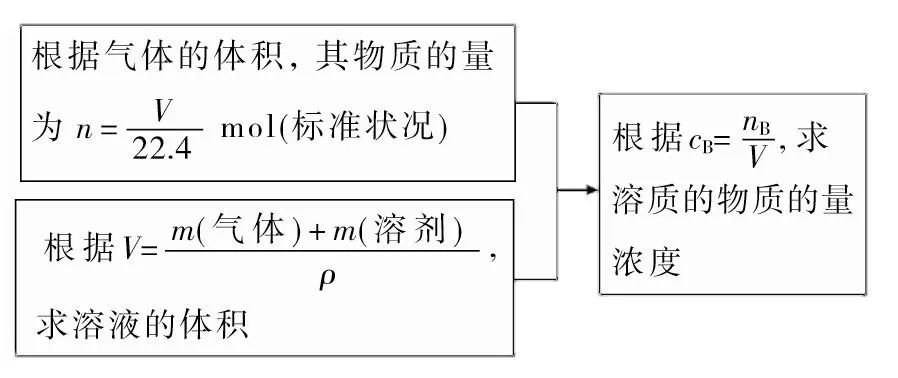
(4)质量分数与c之间的关系
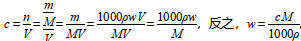
。
以上仅为部分内容
完整文档请于文末获取!

以上《高一化学期中复习宝典》的部分内容,为方便学生复习,完整资料文件请按以下步骤获取:
1.识别二维码,关注【广州高中微课】;
2.回复【190501】,即可获取;

往期回顾
高一 | 期中考语文复习精练精解①
高一 | 期中考语文复习精练精解②
高一 | 期中考数学复习精练精解①
高一 | 期中【英语】复习精练精解①
高一 | 期中【物理】复习精练精解①
点一下,分享给大家!